Пренатальная неинвазивная диагностика
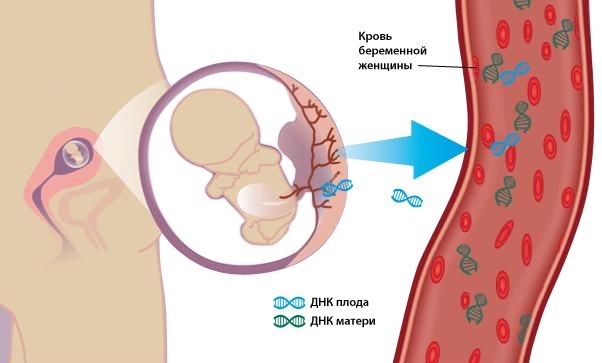
Пренатальная диагностика – раздел медицинской генетики, возникший в 80-х годах ХХв. на стыке клинических дисциплин (акушерства, гинекологии, неонатологии) и фундаментальных наук (генетики человека, цитогенетики, молекулярной биологии, эмбриологии, биохимии, патофизиологии)
Основные задачи пренатальной диагностики
- Предоставление будущим родителям исчерпывающей информации о степени риска рождения больного ребёнка
- Определение прогноза здоровья будущих детей
- При наличии высокого риска – предоставление информации о возможности прерывания беременности и последствиях принятого родителям и решения – родить больного ребёнка или прервать беременность
- Обеспечение ранней диагностики патологии и оптимальной тактики ведения беременности
Пренатальная диагностика анеуплоидий
У человека в норме 46 хромосом или 23 пары, но порой происходят наследственные изменения, при которых число хромосом в клетках становится не кратным основному набору. Это может выразится в наличии добавочной хромосомы, или в нехватке какой-либо хромосомы, что и называется анеуплодиией. Различают моносомии, трисомии и очень редкие тетра- и пентасомии.
В нашей клинике мы сможем продиагностировать на ранних сроках анеуплоидии 13, 18, 21, Х и Y хромосом . Неинвазивная пренатальная диагностика трисомий 13, 18, 21, Х и Y хромосом методом rMPS (Random Massively Parallel Sequencing) - высокопроизводительного параллельного секвенирования.
- Возраст матери от 30 лет;
- Семейным парам, имеющим детей с врожденными аномалиями развития;
- По показаниям УЗИ (маркеры хромосомных патологий);
- В 1 и во 2 триместре снижение уровня РАРР-А в сочетании с повышенным уровнем свободного β-ХГЧ.
Преимущества анализа
- Безопасный анализ анеуплоидии хромосом 13, 18, 21, X и Y;
- Точность метода 99,8%;
- Возможность проведения анализа с 9 недели беременности , что позволит в случае его положительного результата на хромосомную патологию своевременно решить вопрос о возможности прерывания беременности;
- Не требует дополнительной подготовки пациента;
- Результат анализа содержит наличие либо полное отсутствие трисомии хромосом;
- Срок выдачи результата 10-14 дней .
Синдром Паттау (трисомия 13, трисомия D )
Отличительные признаки:
Пороки развития глаз, носа и верхней губы, прозэнцефалические пороки, полидактилия, длинные выпуклые ногти, очаговая аплазия кожи волосистой части головы.
Встречаемость: 1: 5000-7000 новорожденных
Синдром Эдвардса (трисомия 18, трисомия Е)
Отличительные признаки:
Сжатые кулаки с перекрытием пальцев, короткая грудина, кожный узор в виде дуг на большинстве пальцев
Встречаемость : 1: 3000 новорожденных. Больных девочек рождается в 3 раза больше мальчиков
Синдром Дауна (трисомия 21, трисомия G )
Отличительные признаки:
Умственная отсталость, мышечная гипотония, плоское лицо, монголоидный разрез глаз, маленькие ушные раковины
Встречаемость : 1: 660 новорожденных (самая частая врожденная болезнь человека) Соотношение мальчиков и девочек с синдромом Дауна составляет 1:1
Синдром Шершевского-Тернера (синдром моносомии по Х-хромосоме)
Отличительные признаки:
Низкорослость, широкая грудная клетка, гипертелоризм сосков, врожденный лимфатический отек кистей и стоп, крыловидные складки, короткая шея
Встречаемость : 1: 2500 девочек
Синдром трипло-Х (47, XXX )
Отличительные признаки:
На начальных стадиях никаких отклонений в физическом и психическом развитии не наблюдается. Однако со временем часто встречается неглубокая умственная отсталость, задержка в физическом развитии, высокий рост и иногда даже бесплодие
Встречаемость: 1: 1000 девочек
Синдром Клайнфельтера (47, XXY )
Отличительные признаки:
Гипогонадизм, длинные ноги, снижение интелекта, поведенческие расстройства
Встречаемость: 1: 1000 мальчиков
Синдром дисомии по Y -хромосоме (47, Х YY )
Отличительные признаки:
Высокий рост, поведенческие расстройства
Встречаемость: 1: 840 мальчиков
Своевременная диагностика- залог успешного лечения и выздоравления!
Остались вопросы или хотите пройти обследование? Экоклиника “Институт планирования семьи” ждёт Вас!
Наш адрес: г.Усть-Каменогорск, пр.Независимости, 72
Контактные телефоны Call-центра: +7(7232)75-19-62, +7(777)147-33-99, +7(777)138-94-94
HLA-типирование при планировании беременности

При неудачных попытках родить ребёнка супруги задаются вопросом — в чём причина? Первичные анализы и исследования часто не могут ответить на него. Для выявления проблемы врачи дополнительно назначают HLA-типирование пары. Иммунологическая идентичность родителей становится серьёзным препятствием на пути к рождению ребёнка.
Этот тест назначают только при неудачных попытках экстракорпорального оплодотворения и в случаях с постоянным не вынашиванием плода
Для полноценного вынашивания ребёнка антигены отца и матери должны различаться. Зародыш, сформированный в результате соединения родительских половых клеток, обладает специализированными антигенами, «чужими» для иммунитета матери. Организм женщины реагирует на новые клетки ребёнка включением особых механизмов, защищающих плод: синтезируются антитела-протекторы, подавляющие специализированные NK-клетки-киллеры. Если этого не происходит, последние начинают убивать зародыш, что приводит к прерыванию беременности.
Если антигены отца и матери совпадают, то ребёнок будет носителем антигенов идентичных материнским. В таком случае женский организм считает клетки зародыша своими, а значит, не запускает защитные механизмы для сохранности плода. Иммунитет воспринимает плод как некое опухолевое заболевание и пытается его уничтожить или приостановить деление клеток. В обычной жизни это спасает нас от многих заболеваний, но в этом случае становится причиной некроза в тканях зародыша и приводит к выкидышу.
Комплекс гистосовместимости оказывает влияние на сам процесс оплодотворения, прикрепление зародыша и вынашиваемость плода. Существует прямая зависимость: чем больше аллелей HLA-генов оказалось схожим у супругов, тем больше риск выкидыша. Около 35% пар с повторяющимися случаями выкидыша имеют по 2–3 совпадения. Если обнаружено четыре и больше сходных аллелей, то не вынашиваемость и безуспешные попытки ЭКО будут почти во всех случаях.
Генетический анализ на HLA-антигенную совместимость супругов поможет выяснить, является ли бесплодие или не вынашивание следствием генетической несовместимости пары. В случае подтверждения диагноза не теряйте надежду: современная медицина зачастую способна решить эту проблему и помочь в появлении на свет здорового малыша. Иммунизация матери является распространённым методом борьбы с генетической идентичностью родителей по HLA-антигенам.
Своевременная диагностика- залог успешного лечения и выздоравления!
Остались вопросы или хотите пройти обследование? Экоклиника “Институт планирования семьи” ждёт Вас!
Наш адрес: г.Усть-Каменогорск, пр.Независимости, 72
Контактные телефоны Call-центра: +7(7232)75-19-62, +7(777)147-33-99, +7(777)138-94-94
Анализ микроделеций локуса AZF Y-хромосомы (14 локусов) необходим для диагностики мужского бесплодия
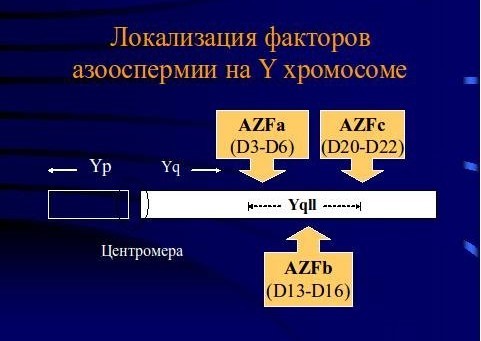
Микроделеция Y хромосомы – это делеция определенных участков Y хромосомы - AZF локуса (фактора азооспермии). AZF локус находится в длинном плече Y-хромосомы (Yq11). Гены, расположенные в этом локусе, играют важную роль в процессе сперматогенеза.
Исследование микроделеции локуса AZF Y хромосомы в ряде случаев позволяет:
- установить генетическую причину нарушений сперматогенеза;
- проводить дифференциальную диагностику бесплодия у мужчин;
- корректировать терапевтические подходы, избегая "лишнего" лечения, а также;
- прогнозировать возможность получения сперматозоидов для ИКСИ или ЭКО;
- прогнозировать возможность получения сперматозоидов при тестикулярной биопсии;
- прогнозировать для потомства мужского пола возможность наследования репродуктивных проблем отца;
- рекомендовать использование предимплантационной диагностики для исключения наследования репродуктивных проблем отца.
Бесплодием страдают около 25% супружеских пар, при этом примерно в 60% случаев оно обусловлено нарушением репродуктивной функции со стороны мужчин. Бесплодие у мужчин в 40-50% случаев может быть связано с нарушениями количественных и/или качественных показателей эякулята. Мутации генов, контролирующих этапы сперматогенеза, могут приводить к нарушению подвижности, морфологических и фертильных свойств сперматозоидов, блоку сперматогенеза, проявляясь в диапазоне от легкого снижения сперматогенной активности до полного отсутствия половых клеток в семенных канальцах (синдром "только клетки Сертоли»).
Делеции AZFa - и AZFb -субрегионов ассоциированы с невозможностью получения зрелых половых клеток, а у пациентов с AZFс -делециями примерно в 71% случаев удается получить зрелые сперматозоиды.
Как показывают статистические данные, что AZF-микроделеции обнаруживаются у 7,3% мужчин с бесплодием. Большая часть (66%) микроделеций найдена у пациентов с азооспермией, в 28% случаев - у пациентов с олигозооспермией тяжелой степени.
Своевременная диагностика- залог успешного лечения и выздоравления!
Остались вопросы или хотите пройти обследование? Экоклиника “Институт планирования семьи” ждёт Вас!
Наш адрес: г.Усть-Каменогорск, пр.Независимости, 72
Контактные телефоны Call-центра: +7(7232)75-19-62, +7(777)147-33-99, +7(777)138-94-94
Муковисцидоз
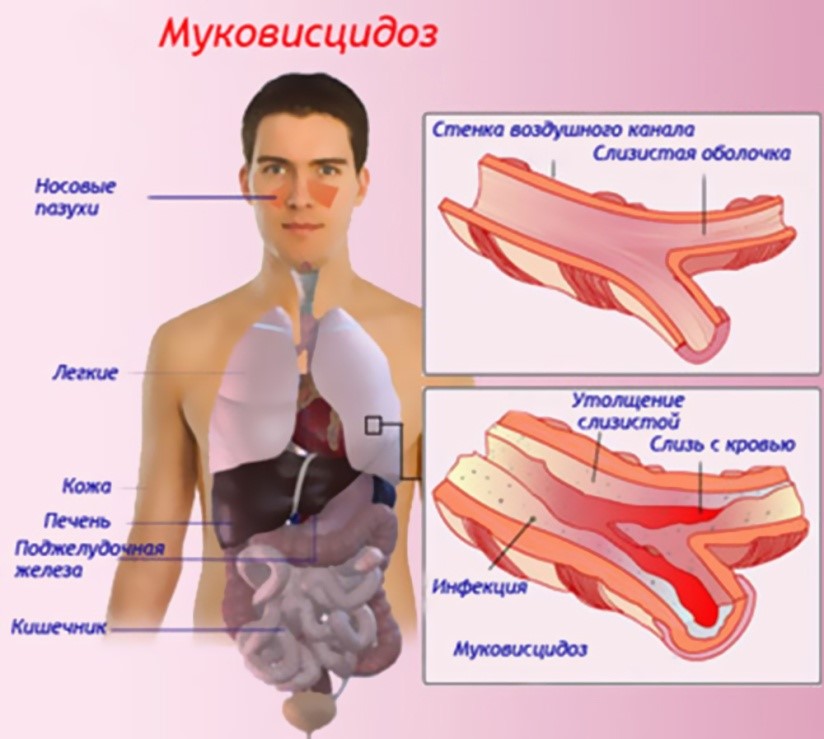
Муковисцидоз - наследственное заболевание, при котором поражаются экзокринные железы организма (железы бронхолегочной системы, поджелудочная железа, печень, потовые, слюнные железы, железы кишечника, половые железы).
Муковисцидоз связан с мутацией в гене CFTR (CYSTIC FIBROSIS TRANSMEMBRANE CONDUCTANCE REGULATOR, или МВТР - трансмембранный регулятор муковисцидоза). Этот ген локализован на длинном плече хромосомы 7(7q31.2).
В настоящее время описано более полутора тысяч различных мутаций в этом гене, однако лишь несколько из них встречаются с частотой более 1%. Самой распространенной мутацией является Del F508 (делеция 3 нуклеотидов, кодирующих фенилаланин в положении 508). В клинике проводится определение 19 наиболее частых мутаций в гене CFTR: F508del, CFTRdele2,3(21kb), I507del, 1677delTA, 2143delT, 2184insA, 394delTT, 3821delT, L138ins, W1282X, G542X, 3849+10kbC>T, N1303K, R334W, 604insA, 3944delTG, 621+1g>a, S1196X, E92K. Суммарная информативность системы составляет 78% от общего числа поврежденных при муковисцидозе хромосом.
Кроме прямой диагностики (определения мутации в гене CFTR) разработана система косвенной ДНК-диагностки для семей, имеющих больных муковисцидозом. Данная система позволяет с помощью анализа длин фрагментов полиморфных маркеров проследить передачу хромосом в семье и обнаружить, какие из хромосом, несущих повреждение, переданы плоду (в случае пренатальной диагностики) или другим родственникам. Муковисцидоз наследуется по аутосомно-рецессивному типу. Это означает, что муковисцидоз возникает у ребенка, который получил по гену с мутацией от обоих родителей – и от мамы, и от папы. Муковисцидоз одинаково часто встречается у мальчиков и у девочек.
В настоящее время возможна диагностика данного заболевания на ранних сроках беременности, поэтому большое значение приобретает медико-генетическое консультирование семей, в которых есть больные муковисцидозом.
Своевременная диагностика- залог успешного лечения и выздоравления!
Остались вопросы или хотите пройти обследование? Экоклиника “Институт планирования семьи” ждёт Вас!
Наш адрес: г.Усть-Каменогорск, пр.Независимости, 72
Контактные телефоны Call-центра: +7(7232)75-19-62, +7(777)147-33-99, +7(777)138-94-94
Диагностика Тромбофилии
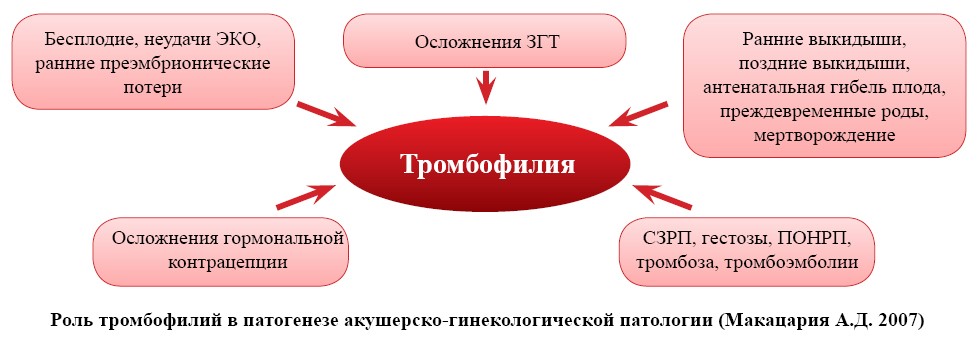
Тромбофилия – предрасположенность к развитию рецидивирующих сосудистых тромбозов (преимущественно венозных) различной локализации. Заболевание обусловлено генетической или приобретенной патологией клеток крови или дефектами свертывающей системы крови.
По различным источникам теми или иными формами тромбофилии страдает около 40% взрослого населения. Отмечается постоянный рост количества тромбозов, обусловленный целым рядом факторов: «старением» населения, гиподинамией, наличием хронических заболеваний и т.д.
Риск развития тромбофилии увеличивается при наличии генетической предрасположенности, некоторых приобретенных заболеваниях крови, атеросклерозе , злокачественных новообразованиях, мерцательной аритмии , варикозном расширении вен нижних конечностей, ряде аутоиммунных заболеваний, артериальной гипертензии .
Вероятность развития тромбофилии возрастает после перенесенного инсульта или инфаркта. Риск образования тромбов увеличивается после травм и хирургических вмешательств, при продолжительной малоподвижности, при ожирении , в период беременности , при приеме гормональных контрацептивов. Фактором риска является курение.
Мутации, которые исследуются:
- Лейденская мутация (коагуляционный фактор V гена F5)
- Мутация протромбина (коагуляционный фактор II гена F2)
- Мутация метилентетригидрофолатредуктазы (ген MTHFR)
- Мутация метионинсинтазы (ген МТR)
- Мутация-1 интегрина α2 (ген ITGA2)
Мутация Лейден
1691 G -> A коагуляционного фактора V ( F 5)
Физиология и генетика.
Коагуляционный фактор V или фактор V свертывания крови является белковым кофактором при образовании тромбина из протромбина. Полиморфизм G1691A является показателем риска развития венозных тромбозов. Это точечная (однонуклеотидная) мутация гена, кодирующего фактор V свертывания крови, придает устойчивость активной форме фактора V к расщепляющему действию специализированного регулирующего фермента, С-белка, что приводит к гиперкоагуляции. Соответственно, риск образования тромбов повышается. Распространенность мутации в популяциях европейского типа составляет 2-6%.
Риск тромбозов глубоких вен (TГВ): в 7 раз выше у гетерозиготных носителей Лейденской мутации гена F5 Arg506Gln и в 80 раз выше у гомозигот.
Дополнительные факторы, влияющие на развитие ТГВ, можно разделить на 3 группы:
К первой группе факторов относится изменение гормонального статуса:
– Использование пероральных контрацептивов дополнительно повышает риск развития ТГВ в 30 раз у гетерозигот, в 100 раз при гомозиготном носительстве.
– Беременность – в 16 раз повышает риск ТГВ.
– Гормонзаместительная терапия – в 2-4 раза увеличивает риски.
Ко второй группе факторов относятся повреждения сосудов:
– Катетеризация центральных вен повышает риск ТГВ в 2-3 раза
– Хирургические вмешательства – в 13 раз.
К третьей группе факторов относится обездвиженность: постельный режим и длительные авиа-перелёты. Здесь лишь отмечается увеличение риска, но статистика должна быть более полной:
– Инфекционные и онкологические заболевания также повышают риск развития ТГВ. Риск развития ишемического инсульта у женщин в возрасте 18-49 лет при наличии Лейденской мутации возрастает в 2,6 раза, а на фоне приёма пероральных контрацептивов увеличивается в 11,2 раза.
Показания к анализу.
- Венозный тромбоз
- Развитие тромбоэмболических заболеваний в молодом возрасте;
- Рецидивирующий характер тромбоэмболизмов;
- Сердечно-сосудистые заболевания в семейном анамнезе,
- Заместительная гормонотерапия,
- Прием гормональных контрацептивов,
- Невынашивание беременности,
- Фетоплацентарная недостаточность,
- Внутриутробная гибель плода,
- Токсикоз,
- Задержка развития плода,
- Отслойка плаценты,
- Пациентам, готовящимся к большим полостным операциям (миома матки, кесарево сечение, кисты яичников и пр.).
Мутация протромбина
F 2 (Коагуляционный фактор 2, протромбин)
Физиология и генетика
Протромбин (коагуляционный фактор II или F2 ) является одним из главных компонентов системы свертываемости крови. В ходе ферментативного расщепления протромбина образуется тромбин. Данная реакция является первой стадией образования кровяных сгустков. Мутация гена протромбина G20210A характеризуется заменой нуклеотида гуанина (G) нуклеотидом аденин (A) в позиции 20210. Из-за увеличения экспрессии мутантного гена уровень протромбина может быть в полтора-два раза выше, чем в норме. Мутация наследуется по аутосомно-доминантному типу. Это означает, что тромбофилия возникает даже у гетерозиготного носителя измененного гена (G/A).
Тромбоэмболические заболевания (ТЭ) вызываются нарушениями в системе свертываемости крови. Эти нарушения приводят и к сердечно-сосудистым заболеваниям. Генотип G/A является показателем риска развития тромбозов и инфаркта миокарда. При возникновении тромбозов мутация 20210A часто встречается в сочетании с мутацией Лейден. Генотип G/A позиции 20210 гена протромбина является фактором риска тех же осложнений, которые связанны с мутацией Лейден.
Гетерозиготными носителями гена являются 2-3% представителей европейской расы.
Показания к анализу.
- Инфаркт миокарда,
- Повышенный уровень протромбина крови,
- Тромбоэмболические заболевания в анамнезе,
- Преклонный возраст пациента,
- Невынашивание беременности,
- Фетоплацентарная недостаточность,
- Внутриутробная гибель плода,
- Токсикоз,
- Задержка развития плода,
- Отслойка плаценты,
- Пациентам, готовящимся к большим полостным операциям (миома матки, кесарево сечение, кисты яичников и пр.), курение.
MTHFR (метилентетрагидрофолатредуктаза)
Полиморфизм Ala222Val
Метилентетрагидрофоларедуктаза ( MTHFR ) играет ключевую роль в метаболизме фолиевой кислоты, перенося одноуглеродные метаболиты между реакциями синтеза нуклеотидов и реакциями метилирования. Фермент катализирует восстановление 5,1—метилентетрагидрофолата в 5-метилтетрагидрофолат, который является активной формой фолиевой кислоты, необходимой для образования метионина из гомоцистеина. Полиморфизм 677С> T ( A 223 V ) широко распространен в различных популяциях и связан по крайней мере с тремя группами многофакторных заболеваний – васкулярными заболеваниями, дефектами развития нервной трубки у плода и колоректальной аденомой. Частота встречаемости варианта 677Т в европеоидных популяциях составляет 20-30%. Дефекты в данном гене часто приводят к совершенно различным заболевания с широким спектром клинических симптомов: умственное и физическое отставание в развитии, перинатальная смерть, васкулярные и нейродегенеративные заболевания, диабет, рак и другие.
Вариант 677Т, в часности, обуславливает термолабильность фермента и ассоциируется с повышенным уровнем гомоцистеина в плазме крови. Повышенный уровень гомоцистеина считается одним из факторов раска кардиоваскулярных заболеваний. У носителе варианта Т во время беременности наблюдается дефицит фолиевой кислоты, что приводит к дефектам развития нервной трубки плода. Курение усугубляет влияние варианта 677Т. У насителей двух аллелей Т (гомозиготное состояние) высокий риск развития побочных эффектов при приеме некоторых лекарственных препаратов, используемых в раковой химиотерапии.
Показания к анализу.
- Гипергомоцистеинемия,
- ИБС и инфаркт миокарда,
- Атеросклероз и атеротромбоз,
- Антифосфолипидный синдром,
- Полипоз кишечника,
- Колоректальная аденома и рак,
- Мутации генов BRCA ,
- Цервикальная дисплазия, особенно в сочетании с папилломавирусной инфекцией.
MTR (метионинсинтаза)
Полиморфизм Asp 919 Gly
Ген кодирует синтез 5-метилтетрагидрофола-гомоцистеинметилтрансферазы (метионинсистазы), фермента, отвечающего за синтез метионина из гомоцистеина. Дефицит фермента вследствие мутации Asp919Gly либо мутации MTRRlle 22 Met (фермента регенерирующего MTRR ) увеличивает риск развития мегалобластной анемии, приводит к накоплению гомоцистеина.
Показания к анализу.
- Повторные эпизоды венозных тромбоэмболий в анамнезе,
- Эпизоды тромбоэмболий во время беременности, в послеродовом периоде и во время приема оральных контрацептивов,
- Необъяснимая гибель плода во 2 или 3 триместрах беременности,
- Мегалобластная анемия,
- Мутация MTRR .
Мутация-1 интегрина α2 (ген ITGA2)
Функция гена
Ген ITGA2 кодирует белок интегрин альфа-2 – мембранный гликопротеин, известный как GPIa (platelet glycoprotein Ia, или very late activation protein (VLA), экспрессирующийся на мембранах различных клеток, включая мегакариоциты, фибробласты и тромбоциты. На мембране тромбоцитов GPIa образует комплекс с GPIIa, представляющий собой один из рецепторов коллагена.
Показания к анализу.
- Тромбоэмболия
- Инфаркт миокарда
- Ишемический инсульт
Своевременная диагностика- залог успешного лечения и выздоравления!
Остались вопросы или хотите пройти обследование? Экоклиника “Институт планирования семьи” ждёт Вас!
Наш адрес: г.Усть-Каменогорск, пр.Независимости, 72
Контактные телефоны Call-центра: +7(7232)75-19-62, +7(777)147-33-99, +7(777)138-94-94

 Call-центр (Пн-Пт: 8:00-17:00): 87771480097
Call-центр (Пн-Пт: 8:00-17:00): 87771480097 WhatsApp: +7(747)623-53-04
WhatsApp: +7(747)623-53-04